რა კითხვები აქვს WHO-ს სინოფარმთან — მტკიცებულებების შეფასება საბოლოო დასკვნამდე
ჯანდაცვის მსოფლიო ორგანიზაციამ გაავრცელა დოკუმენტი, რომლითაც ვიგებთ, თუ რა კომპონენტებში ხდება Sinopharm-ის ვაქცინის შეფასება WHO-ს სტრატეგიული საკონსულტაციო ექსპერტთა ჯგუფის (SAGE) მხრიდან და რა მონაცემებს იყენებენ ისინი ამ შეფასებისთვის. დოკუმენტიდანვე ვიგებთ, ამ ეტაპზე, ექსპერტთა ჯგუფის წინაშე არსებული დასკვნების შესახებაც, რომლებიც სინოფარმის ეფექტიანობასა და უსაფრთხოებას ეხება და იმის შესახებაც, რამდენად სარწმუნოდ მიიჩნევს ექსპერტთა ჯგუფი მათ წინაშე წარდგენილ მონაცემებს.
აღსანიშნავია, რომ ამის მიუხედავად, ავტორიზაციის შესახებ WHO-ს საბოლოო გადაწყვეტილება, ჯერჯერობით, არ ვიცით და ის მიმდინარე კვირაში გახდება ცნობილი, მანამდე კი შეგვიძლია გადავხედოთ იმ მონაცემებსა და დასკვნებს, რომელთაც WHO, ამ ეტაპზე, ვაქცინის გამოყენების ნებართვის გასაცემად განიხილავს.
საგანგებო გამოყენების პირობებში, უკვე სინოფარმის > 65 მილიონი დოზაა გაკეთებული მსოფლიოს მასშტაბით. ის 45-ზე მეტი ქვეყნის/მარეგულირებლის მიერაა ავტორიზებული. სინოფარმის 2 დოზიანი კოვიდვაქცინის დოზებს შორის ინტერვალი 21-28 დღეა. ვაქცინის ეფექტიანობა, მე-3 ფაზის კლინიკური კვლევების მიხედვით, 78%-ია.
დოკუმენტის თანახმად, ავტორიზაციამდე SAGE-ის გუნდმა უნდა გასცეს პასუხი შემდეგ კითხვებს და განიხილოს მათთან მიმართებაში არსებული მტკიცებულებები:
- რა მოწმობს ვაქცინის ეფექტიანობასა და უსაფრთხოებას ზრდასრულებში (18-59 წელი)?
- რა მოწმობს იმას, რომ ვაქცინის გამოყენება უფრო მაღალ ასაკობრივ ჯგუფებშიც შეიძლება?
- რა მოწმობს იმას, რომ ვაქცინა ეფექტიანი და უსაფრთხოა ქრონიკული დაავადებებისა თუ ჯანმრთელობის სხვაგვარი პრობლემების მქონეთათვის?
უსაფრთხოების მიმოხილვა (ვაქცინის კლინიკურ კვლევაზე დაყრდნობით)
- პრეკლინიკურ კვლევებში უსაფრთხოებასთან დაკავშირებული გართულებები არ გამოვლენილა;
- კლინიკური უსაფრთხოების ეს შეფასება ეყრდნობა 16 671 მონაწილის მონაცემს, რომელთაც BBIBP-CorV-ის (იგივე სინოფარმი) ავტორიზებული დოზა მიიღეს;
- ვაქცინაციის შემდგომი გვერდითი მოვლენების უმეტესობა იყო მსუბუქიდან ზომიერამდე: ყველაზე ხშირი გვერდითი მოვლენები იყო ტკივილი ინექციის ადგილზე, თავის ტკივილი და სისუსტე;
- სერიოზული გვერდითი მოვლენებისა და ნევროლოგიურ დარღვევებთან დაკავშირებული გვერდითი მოვლენების, ან 3+ ხარისხის გვერდითი მოვლენების მხრივ, ვაქცინასა და პლაცებოს ჯგუფს შორის განსხვავება არ გამოვლენილა;
- ორი სერიოზული გვერდითი მოვლენა შესაძლოა დაკავშირებული იყოს ვაქცინაციასთან (ძლიერი გულისრევა და ანთებითი დემიელინაციის სინდრომი/მწვავე დისემინირებული ენცეფალომიელიტი);
- ერთი სიკვდილი დაფიქსირდა კვლევის მესამე ფაზაზე, პლაცებოს ჯგუფში (პლაცებოს ჯგუფი საკონტროლოა და მას ვაქცინით არ ცრიან);
- კვლევის მესამე ფაზაზე, BBIBP-CorV-ით აცრილთა ჯგუფში ერთი თრომბოზის შემთხვევა დაფიქსირდა;
- ყველა მწვავე ალერგიული რეაქცია იყო 1 და 2 ხარისხის, BBIBP-CorV-ით ვაქცინირებულთა ჯგუფში (აღსანიშნავია, რომ ანაფილაქსია არ დაფიქსირებულა). პლაცებოთი და ვაქცინით აცრილთა ჯგუფებს შორის ალერგიული რეაქციების სიხშირის კუთხით განსხვავება არ ყოფილა.
ჩინეთში ავტორიზაციის შემდგომი უსაფრთხოების შეჯამება
აღსანიშნავია, რომ სინოფარმზე ჩინეთის მედიცინის პროდუქტების ნაციონალურმა სააგენტომ ავტორიზაცია 2020 წლის 31 დეკემბერს გასცა. მას შემდეგ ეს ვაქცინა 45 ქვეყნის/მარეგულირებლის მიერაა ავტორიზებული, 18 წლის და ზემოთ მოქალაქეების ასაცრელად.
როგორც დოკუმენტიდან ვიგებთ, SAGE-ის წინაშე, ამ კუთხით არსებული მონაცემები ვაქცინის ჩინეთის საშინაო მოხმარებითაა შემოფარგლული.
მონაცემები მოიცავს 5.9 მილიონ ვაქცინირებულს ჩინეთში, რომელთაგანაც 1 453 ადამიანში დაფიქსირებულია გვერდითი მოვლენა (24.6/100 000 დოზაზე). აქედან 108 ლოკალური რეაქციიდან იყო 2 მძიმე ინდურაცია (ნანემსარის გამაგრება), ხოლო 6 პაციენტში სიწითლე და შეშუპება. ცხელების 202 შემთხვევიდან 86 კლასიფიცირებულია როგორც მძიმე (≥38,6 გრადუსი ცელსიუსით). დაფიქსირდა სახის ნერვის სიმპტომის 11 შემთხვევა, რომელთაგანაც, შეფასების მიხედვით, არც ერთი უკავშირდება ვაქცინაციას. შემთხვევათა ნაწილი კი უკავშირდებოდა ალერგიულ გამონაყარსა და ჭინჭრის ციებას.
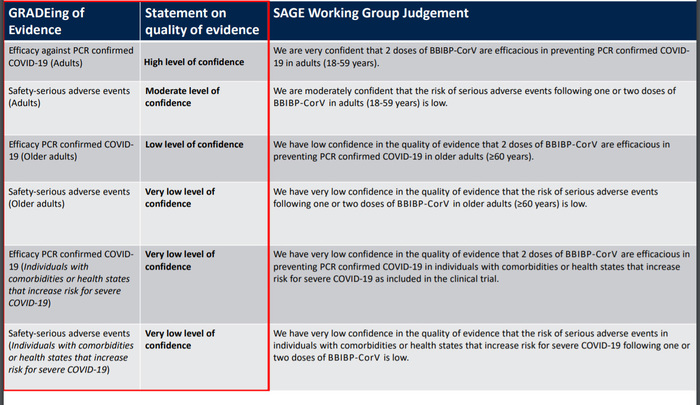
ამ ეტაპზე (საბოლოო დასკვნამდე) როგორ აფასებს WHO სინოფარმის ეფექტიანობასა თუ უსაფრთხოებასთან დაკავშირებული მტკიცებულებების ხარისხს
WHO-ს მიერ გამოქვეყნებული დოკუმენტის მიხედვით, ავტორიზაციაზე მომუშავე გუნდის თანახმად:
- მაღალი ხარისხის მტკიცებულებაა წარმოდგენილი და შესაბამისად, მაღალი სარწმუნოობით სარგებლობს ვაქცინის ეფექტიანობასთან დაკავშირებული მონაცემები PCR-ით დადასტურებულ COVID-19-თან მიმართებაში (ზრდასრულები, 18-59 წელი);
- საშუალო ხარისხის მტკიცებულებებია წარმოდგენილი და შესაბამისად, საშუალოდ სარწმუნოა ვაქცინით გამოწვეულ სერიოზულ გვერდით მოვლენებთან დაკავშირებული მონაცემები. ეს ნიშნავს, რომ WHO საშუალოდაა დარწმუნებული, რომ ვაქცინის მიერ გამოწვეული სერიოზული გვერდითი მოვლენების რისკი მცირეა.
- დაბალი ხარისხის სარწმუნოობა აქვს 60 წელზე ზემოთ პაციენტებში BBIBP-CorV-ის (ანუ სინოფარმის) ინექციის ეფექტიანობას;
- ძალიან დაბალი ხარისხის მტკიცებულებებია წარმოდგენილი თანმხლები დაავადებების მქონე პირებში ვაქცინის ეფექტიანობისა და უსაფრთხოების კუთხით.
საქართველოს ჯანდაცვის სამინისტროში აცხადებენ, რომ სინოფარმით ვაქცინაცია 4 მაისს დაიწყება და "ავტორიზაცია მალე დაეწევა". NCDC-ის ინფორმაციით, ჩინური ვაქცინით აცრა დაიწყება იმუნიზაციის პროცესში ჩართულ 30 დაწესებულებაში, 33 ამცრელი ბრიგადით.
სინოფარმზე რეგისტრაცია 18 წლის ზემოთ მოქალაქეებსაც შეუძლიათ. ჯანდაცვის მინისტრ ეკატერინე ტიკარაძის თქმით, ამის საფუძველს იძლევა არაერთი კვლევა, რომლის მიხედვითაც 18-დან 60 წლამდე მოქალაქეებისთვის სინოფარმი უსაფრთხო ვაქცინაა.











კომენტარები